La carga que generan las enfermedades transmisibles está fuertemente condicionada por factores económicos y sociales. Con estas premisas, la situación epidemiológica de una enfermedad infecciosa y su posible evolución en una población se valora a través de la infecciosidad del agente para causar nuevas infecciones, de su capacidad de generar inmunidad y de la disponibilidad de vacunas(1). Las estimaciones basadas en estos conceptos han tenido especial interés en el caso del SARS-CoV-2. Valoramos en este post la situación actual y futura de la pandemia a partir del concepto de inmunidad de grupo o inmunidad colectiva (herd immunity en inglés).
Inmunidad colectiva, número básico y número efectivo de reproducción
El término «inmunidad colectiva» se ha usado para describir la proporción de individuos inmunes a una enfermedad en una población. Su efecto en una población se traduce en que el riesgo de infección entre los individuos susceptibles se reduce por la existencia y la proximidad de individuos inmunes. A este efecto se le ha denominado “protección indirecta” o “efecto rebaño”.
Conectado con este concepto tenemos el número básico de reproducción (R0), que es el número esperado de nuevas infecciones generadas directamente por un caso en una población donde todos los individuos son susceptibles. La definición asume que ningún otro individuo está infectado naturalmente ni inmunizado mediante vacunación. El número efectivo de reproducción (Rt) se refiere al número de nuevos infectados producidos por cada caso en un estadio en el que puede haber individuos ya inmunizados o en el que se toman medidas para reducir la transmisión, como el uso de mascarillas en el caso del SARS-CoV-2 (1).
https://academic.oup.com/aje/article-abstract/141/3/187/62451?redirectedFrom=fulltext&login=false
El teorema de la inmunidad umbral
Este teorema plantea que si la vacunación estuviese distribuida de forma homogénea en una población y si los miembros de esa población se mezclasen al azar, de forma que si cada individuo, en promedio, contactase con R0 individuos de forma eficiente para transmitir la infección, la incidencia de la infección disminuiría si la proporción de personas inmunes excediese a (R0 -1)/ R0; o 1 – 1/ R0 (Figura 1). Veamos un ejemplo concreto: para el sarampión una R0 de 16 comporta que el 93,75% de la población esté vacunada para conseguir reducir la transmisión [(16-1/16) x 100 = 93.75%] (figura 1). El planteamiento de la inmunidad umbral, aunque persiste, ha sido criticado. El valor R0 mide el número promedio de casos secundarios generados por una persona infectada «típica». Este promedio depende de cómo los grupos interactúan, de manera que en grupos más conectados el valor R0 es más alto y el umbral de vacunación debe ser mayor. Si además las vacunas no se distribuyen de forma homogénea en la población y existen grupos con coberturas más bajas, el nivel crítico de vacunación también será más elevado (1).
El futuro de la pandemia por SARS-CoV-2
Figura 1. Relación entre el Número básico de reproducción (R0) y el umbral de inmunidad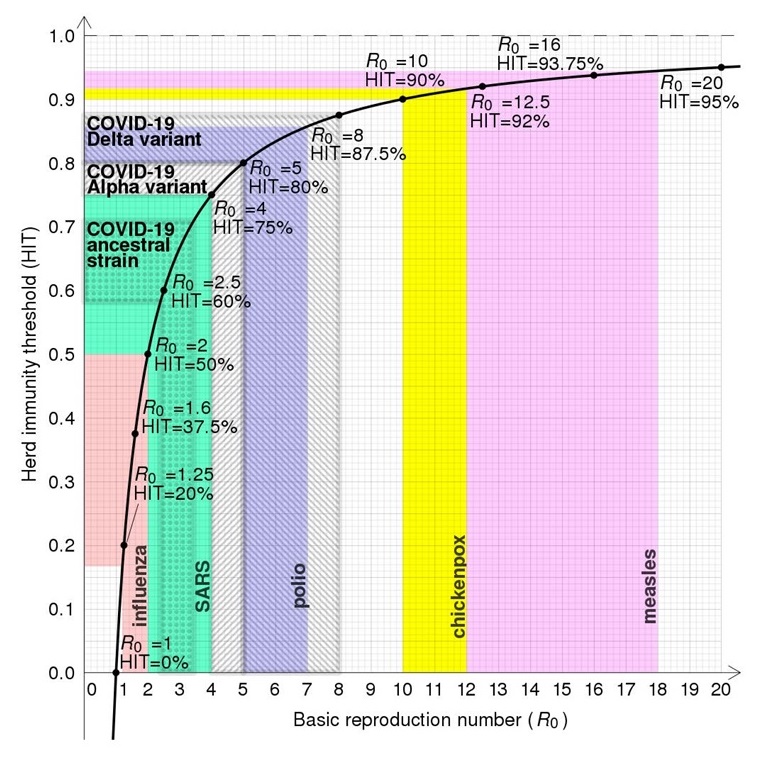 Fuente: https://en.wikipedia.org/wiki/Herd_immunity#/media/File:Herd_immunity_threshold_vs_r0.svg
Fuente: https://en.wikipedia.org/wiki/Herd_immunity#/media/File:Herd_immunity_threshold_vs_r0.svg
En el caso de SARS-CoV-2 se estimó inicialmente el valor de R0 entre 2 y 5 y un nivel crítico de inmunidad del 60% para su control. Sin embargo, la reducción de la inmunidad y la aparición de nuevas variantes, que escapan a la inmunidad, aumentarían el nivel crítico de vacunación hasta un nivel en el que no sería viable su control exclusivamente con las vacunas.
Diversos estudios señalan el papel protector de las infecciones previas por SARS-CoV-2 para reducir el riesgo de nuevas infecciones. Se considera que la inmunidad natural generada por la infección por el SARS-CoV-2 generaría una respuesta contra múltiples antígenos, a diferencia de las vacunas que inducen inmunidad exclusivamente contra la proteína S de la espícula del virus (2), (3). Estos resultados serían congruentes con estudios de seroprevalencia recientes en los que se constata que en el periodo de circulación de las subvariantes de Omicron BA.4 y BA.5, las personas con anticuerpos N contra la nucleocápside inducidos por infección natural presentaban una reducción significativa de la incidencia de COVID-19, mientras que en las personas que solo presentaban anticuerpos S contra la espícula inducidas por la vacuna, y por tanto sin infecciones previas, no se modificaba el riesgo de COVID-19 (4).
Tenemos que dar al César lo que es del César, y en el caso que nos ocupa tenemos que reconocer a la infección natural su papel en la inmunidad del SARS-CoV-2. La buena noticia es que este papel protector inducido por la infección natural puede ser mayor en las personas con inmunidad híbrida por haber sido vacunadas tras el padecimiento de la infección (5), (6). Aunque algunos investigadores discrepan, este sería el argumento que justificaría el uso de dosis repetidas de vacunas en el futuro ya que esta inmunidad híbrida sería también superior y tendría mayor duración que la conferida exclusivamente por la vacunación (6).
Las implicaciones prácticas son que se tendrá que vigilar de forma detallada la intensidad de transmisión del SARS-CoV-2 en las poblaciones y decidir en qué momento se precisan dosis adicionales de vacuna para mantener un nivel de inmunidad hibrida en la población que permita mantener la transmisión a unos niveles que no comprometan la salud de los grupos vulnerables ni el funcionamiento del sistema sanitario.
En este contexto, la vigilancia epidemiológica, como ocurre en el resto de enfermedades prevenibles por vacunas, es clave para tener información actualizada sobre eventuales incrementos de la transmisión, gravedad y/o letalidad que aconsejen adoptar, en el conjunto de la población o en grupos de riesgo, medidas no farmacológicas específicas que reduzcan la transmisión y protejan a las personas más vulnerables.
Imagen_HerdImmunity_bloc_GS
Autores

Pere Godoy, Jesús Castilla, Ángela Domínguez, Jenaro Astray, Irene Barrabeig, José Tuells por el grupo de vacunas de la Sociedad Española de Epidemiología
Referencias
1. Fox P, Elveback L, Scott W, Gatewood L, Ackerman E. Invited commentary on “herd immunity: Basic concept and relevance to public health immunization practices.” Am J Epidemiol. 1971;94(3):179–89.
2. Bobrovitz N, Ware H, Ma X, Li Z, Hosseini R, Cao C, et al. Protective effectiveness of previous SARS-CoV-2 infection and hybrid immunity against the omicron variant and severe disease : a systematic review and meta-regression. Lancet Infect Dis [Internet]. 2023;23(5):556–67. Available from: http://dx.doi.org/10.1016/S1473-3099(22)00801-5
3. Ellingson KD, Hollister J, Porter CJ, Khan SM, Feldstein LR, Allison L, et al. Risk factors for reinfection with SARS-CoV-2 Omicron variant among previously infected frontline workers. Emerg Infect Dis. 2023;29(3):599–604.
4. Castilla J, Lecea Ó, Salas CM, Quílez D, Miqueleiz A, Trobajo-Sanmartín C, et al. Seroprevalence of antibodies against SARS-CoV-2 and risk of COVID-19 in Navarre, Spain, May to July 2022. Euro Surveill. 2022;27(33):0–6.
5. Altarawneh HN, Chemaitelly H, Ayoub HH, Tang P, Hasan MR, Yassine HM, et al. Effects of previous infection and vaccination on symptomatic Omicron infections. N Engl J Med. 2022;387(1):21–34.
6. Hall V, Foulkes S, Insalata F, Kirwan P, Saei A, Atti A, et al. Protection against SARS-CoV-2 after Covid-19 vaccination and previous infection. N Engl J Med. 2022;386(13):1207–20.

